再生可能エネルギーとCO2からのモノづくり
– 新しい発酵工業への挑戦 –
広島大学 中島田 豊
【化石資源のない宇宙船地球号でのモノづくり】
現在、我々は文明生活を支えているエネルギーの大部分を石油、石炭、天然ガスなどの化石資源に大きく依存しています。先進国が現在の生活水準を維持するとともに、発展途上国が経済発展し、より豊かな生活を享受するためには、さらに大きなエネルギー供給が必要です。しかし、化石資源は近い将来確実に枯渇します。このような、エネルギー安全保障と地球温暖化への懸念から、化石資源への過度の依存から脱却するため、太陽光、水力、風力、地熱、そしてバイオマスなど再生可能エネルギーへの転換が推進されています。
しかし、化石資源はエネルギーとしてだけではなく、現在製造されているプラスチックなどの化成品のほぼ全ては化石資源を原材料としており、その枯渇はエネルギーのみならず、現在、生活を豊かにしている全ての物質の不足につながります。では、化石資源枯渇後に人類は何を出発原料としてモノづくりをしているのでしょうか。
答えは水素(以下H2)と二酸化炭素(以下CO2)です。
というのも、エネルギー利用に関わるパラダイムシフトが起きない限り、再生可能エネルギーは電気に変換されます。しかし、化学反応において電気のままでは使いにくい。そこで、電子を水素イオンに結合させた形態、つまりH2として反応器に導入されることになると考えられます。一方、液体燃料、プラスチックなどの基本骨格は炭素で構成されており、これが将来別の元素に置き換わるとは考えにくい。化石資源は炭化水素の集合体であり、石油は長鎖炭化水素を主成分としており、従来の石油化学工業は長鎖炭化水素の限定分解や水素化などの化学修飾により様々な炭素基盤の化合物を製造することができます。しかし、これが無くなれば、逆に単純な炭素化合物を出発原料とせざるを得なくなります。そこで、大量に得られるものはCO2をおいて他にない。従って、化石資源枯渇後、人類はH2とCO2を出発原料として様々なものを製造することになろう。
では、H2とCO2を原料として如何に物質生産を行うのか?
この問題に対して、当研究室では、嫌気性微生物を用いたH2とCO2からの物質生産法に可能性を求めて研究を進めています。
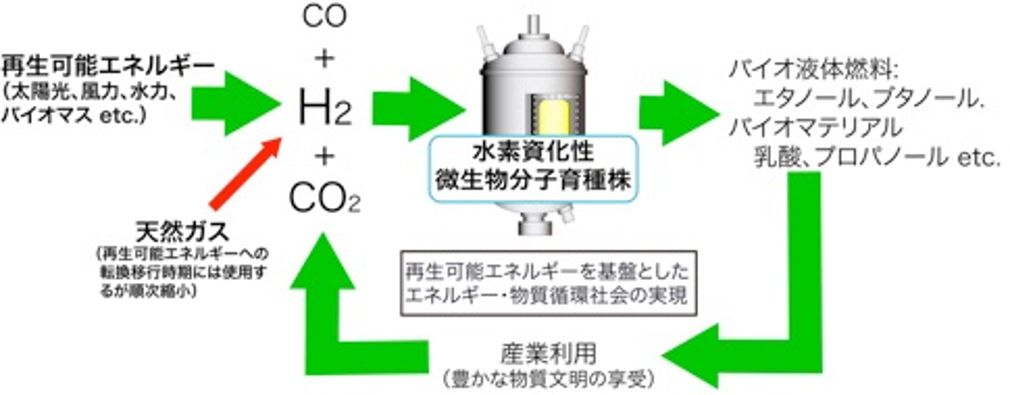
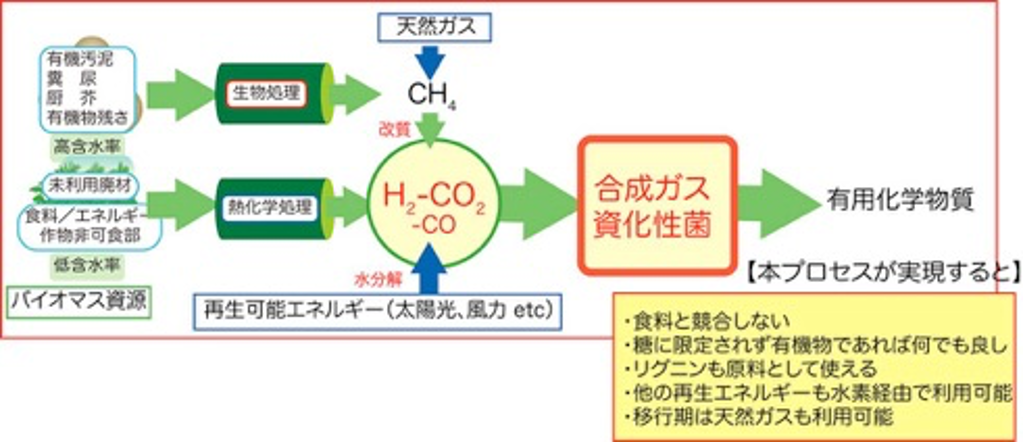
つまり、再生可能エネルギーから、バイオマスの場合は合成ガス(H2-CO-CO2の混合ガス)、太陽光、風力の場合は電気分解により製造されるH2をエネルギー源として、CO2から嫌気微生物代謝を活用して液体燃料、バイオマテリアルを生産するというものです。生産物は産業利用されたのちCO2にもどし、再生可能エネルギーを用いて再利用されます。本プロセスは糖を原料とした従来の発酵プロセスとは違い、天然ガス、石炭などの化石資源から製造される合成ガスも利用できるので、まずは化石資源を主原料とした大量生産プロセスを構築し、将来、再生可能エネルギー活用技術の発達に従い、原料を化石資源から再生可能資源に移行することで、スケールメリットを生かした発酵プロセスとなりえます。
【水素と二酸化炭素を原料として化学品をつくる微生物】
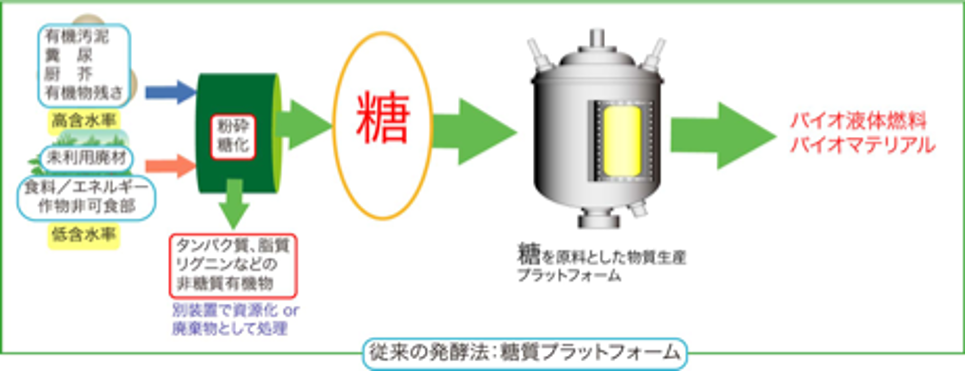
微生物による発酵というと、砂糖やでんぷんからのお酒造りやパン作りを創造するかもしれません。また、味の素などのうま味調味料も、今は微生物を使った発酵生産ですが原料はやはり糖です。現在、微生物に依るモノづくりの原料はほぼ糖に限られています。しかし、微生物の中には、H2-CO2やCOなどのガス基質を利用できるものが知られています。代表的な微生物として、H2-CO2から主に酢酸を生産するホモ酢酸菌の一群があります。ホモ酢酸菌は1936年に初めて発見された古い微生物です。
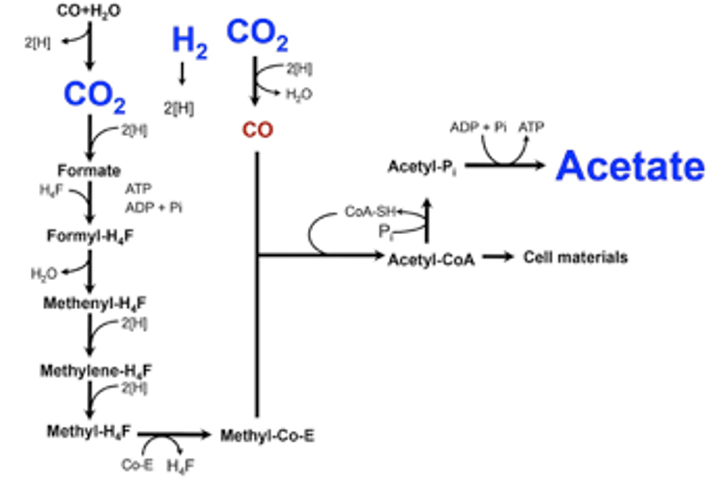
ホモ酢酸菌によるH2-CO2の代謝経路はHarland G. WoodとLars G. Ljungdahlによって詳細に研究され、アセチル-CoA経路、またはWood-Ljungdahl pathwayと呼ばれています。本経路の特徴は、2分子のCO2から1分子のアセチル-CoAを組み立てる点です(右図)。左側の反応系においては、CO2のメチル基への還元が触媒されており、右側の反応系においては、CO2をCOに還元しています。そして、メチル基、CO、そしてCoAが結合してアセチル-CoAが生成されます。アセチル-CoAから最終的に酢酸を生産します。
代謝経路をご覧の通り、酢酸生成菌はCOを利用できますが、化学合成法とは異なり、合成ガスであることは必須ではありません。これは、微生物反応によるガス基質からの物質生産の大きな利点であり、化学合成法では問題になる合成ガス中のCO/H2比率に左右されることなく、 H2 とCO2、そして、わずかな無機塩類があれば酢酸を生産できるのです。 酢酸は、あのすっぱい”お酢”の主成分として知られていますが、化学工業においても非常に重要な化学品です。
酢酸は大事な化学物質ですが、それだけでは用途は限られます。しかし、H2資化性菌の中には酢酸以外に有機酸やアルコールを生産できる微生物も報告されています。例えば、中温性H2資化性微生物であるC. ljungdahlii、C. autoethanogenumなどの微生物は、合成ガスから酢酸の他にエタノール(ガソリン代替液体燃料、化学品原料として利用可能)を生産することが報告されています。また、C. carboxidivoransは、エタノールの他に酪酸やブタノールを生産することが報告されており、酢酸以外の有用物質を生産できる可能性があります。特に、合成ガスからのエタノール生産については、海外でベンチャー企業が実用化を進めています。
一方、好熱性菌によるエタノール生成については、中温菌ほど検討されていませんでした。しかし、60℃前後で生育できる好熱性細菌を、例えば、エタノール生産に利用できれば、培養と蒸留によるエタノール回収を同時に行える効率的なプロセスの開発につながることが考えられます。また、中温菌と比較して、増殖速度が高いことや、コンタミネーション、安全性リスクが低いなどのメリットもあります。
当研究室では、2000年代初めから、民間企業との共同研究により、H2-CO2を基質とする好熱性アルコール生産菌HUC22-1株を発見しました。本菌はH2-CO2を原料として酢酸とエタノールを生産します。ただ、本菌のエタノール生産量は酢酸生産量と比較してまだまだ低く、さらなる収率向上が求められました。
【 水素と二酸化炭素からいろいろなモノをつくる微生物をつくる】
H2-CO2を原料として目的の化学品、例えばエタノールをたくさんつくる微生物を発見できれば理想的なのですが、実際にはトレジャーハンターのごとく運に大きく左右され、簡単に発見できることもありますが、全く見つからない場合も多々あります。このため、近年、目覚ましい進歩を遂げた遺伝子工学を活用して、人為的に目的産物を大量につくる微生物をつくり出そうという動き(合成代謝工学)があります。具体的には、大腸菌(毒性のないものです)や酵母(パンやお酒をつくる微生物)にいろいろな遺伝子を組込み、その微生物が本来つくらないような化学品を生産できるようにするものです。大腸菌や酵母に遺伝子を導入したり、不必要な遺伝子を取り除く技術は大変発達していて、とても簡単に遺伝子を操作することができます。しかし、全ての微生物で同じように簡単に遺伝子を操作できるわけではありません。
H2-CO2 を原料とするホモ酢酸菌の遺伝子組換えは、1994年に中温菌Acetobacterium woodiiで成功したという報告が最初です。そして最近、中温菌C. ljungdahliiの遺伝子組換えが報告され、ブタノール生合成遺伝子が導入されました。その結果、合成ガスから微量ではあるがブタノールが生産されたとして、本菌を合成ガスからの物質生産プラットフォームとして用いることが提案されるなど、中温菌における合成ガスからの発酵生産を可能とする遺伝子工学的手法による微生物の分子育種技術は急激な発展を見せています。
一方、好熱性のホモ酢酸菌については、M. thermoacetica ATCC39073株の全ゲノム配列がすでに決定されていたものの、遺伝子組換え技術の開発などは全く行われていない状況でした。そこで、本研究室では、ゲノム情報に基づき、高熱性ホモ酢酸菌の効率的な遺伝子導入系の開発するとともに、合成ガスからの物質生産プラットフォームとして、様々な液体燃料や有用化学原料生産菌を開発しています。
【関連する公表論文】
-
-
Takemura, K., Kato, J., Kato, S., Fujii, T., Wada, K., Iwasaki, Y., Aoi, Y., Matsushika, A., Murakami, K., and Nakashimada, Y.: Autotrophic growth and ethanol production enabled by diverting acetate flux in the metabolically engineered Moorella thermoacetica, J. Biosci. Bioeng., 132, 569-574 (2021).
-
Kato, J., Takemura, K., Kato, S., Fujii, T., Wada, K., Iwasaki, Y., Aoi, Y., Matsushika, A., Murakami, K., and Nakashimada, Y.: Metabolic engineering of Moorella thermoacetica for thermophilic bioconversion of gaseous substrates to a volatile chemical, AMB Express, 11 (2021).
-
Rahayu, F., Tajima, T., Kato, J., Kato, S., and Nakashimada, Y.: Ethanol yield and sugar usability in thermophilic ethanol production from lignocellulose hydrolysate by genetically engineered Moorella thermoacetica, J. Biosci. Bioeng., 129, 160-164 (2020).
-
Rahayu, F., Kawai, Y., Iwasaki, Y., Yoshida, K., Kita, A., Tajima, T., Kato, J., Murakami, K., Hoshino, T., and Nakashimada, Y.: Thermophilic ethanol fermentation from lignocellulose hydrolysate by genetically engineered Moorella thermoacetica, Bioresour. Technol., 245, 1393-1399 (2017).
-
Iwasaki, Y., Kita, A., Yoshida, K., Tajima, T., Yano, S., Shou, T., Saito, M., Kato, J., Murakami, K., and Nakashimada, Y.: Homolactic acid fermentation by the genetically engineered thermophilic homoacetogen Moorella thermoacetica ATCC 39073, Appl. Environ. Microbiol., 83, e00247 (2017).
-
Kimura, Z., Kita, A., Iwasaki, Y., Nakashimada, Y., Hoshino, T., and Murakami, K.: Glycerol acts as alternative electron sink during syngas fermentation by thermophilic anaerobe Moorella thermoacetica, J. Biosci. Bioeng., 121, 268-273 (2016).
-
Tsukahara, K., Kita, A., Nakashimada, Y., Hoshino, T., and Murakami, K.: Genome-guided analysis of transformation efficiency and carbon dioxide assimilation by Moorella thermoacetica Y72. Gene, 535, 150-155 (2014).
-
Kita, A., Iwasaki, Y., Sakai, S., Okuto, S., Takaoka, K., Suzuki, T., Yano, S., Sawayama, S., Tajima, T., Kato, J., Nishio, N., Murakami, K., and Nakashimada, Y.: Development of genetic transformation and heterologous expression system in carboxydotrophic thermophilic acetogen Moorella thermoacetica. J. Biosci. Bioeng., 115, 347-352 (2013).
-
Iwasaki, Y., Kita, A., Sakai, S., Takaoka, K., Yano, S., Tajima, T., Kato, J., Nishio, N., Murakami, K., and Nakashimada, Y.: Engineering of a functional thermostable kanamycin resistance marker for use in Moorella thermoacetica ATCC39073. FEMS Microbiol. Lett., 343, 8-12 (2013).
-
Nakashimada, Y., Nishio, N., Murakami, N., Maisuer, M., Hosomi, M., and Tajima, T.: Efficient acetate production from formate by Moorella sp. HUC-221. J. Biotechnol., 150, S359-S360 (2010).
-
Sakai, S., Inokuma, K., Nakashimada, Y., and Nishio, N.: Degradation of glyoxylate and glycolate with ATP synthesis by a thermophilic anaerobic bacterium, Moorella sp. strain HUC22-1. Appl. Environ. Microbiol., 74, 1447-1452 (2008).
-
Inokuma, K., Nakashimada, Y., Akahoshi, T., and Nishio, N.: Characterization of enzymes involved in the ethanol production of Moorella sp. HUC22-1. Arch. Microbiol., 188, 37-45 (2007).
-
Sakai, S., Nakashimada, Y., Inokuma, K., Kita, M., Okada, H., and Nishio, N.: Acetate and ethanol production from H2 and CO2 by Moorella sp. using a repeated batch culture. J. Biosci. Bioeng., 99, 252-258 (2005).
- Sakai, S., Nakashimada, Y., Yoshimoto, H., Watanabe, S., Okada, H., and Nishio, N.: Ethanol production from H2 and CO2 by a newly isolated thermophilic bacterium, Moorella sp. HUC22-1. Biotechnol. Lett, 26, 1607-1612 (2004).
-
